Nøgleforskellen mellem nitrogenmonoxid og dinitrogenpentoxid er, at nitrogenmonoxid er en farveløs gas, mens dinitrogenpentoxid er et hvidt fast stof.
Nitrogenmonoxid og dinitrogenpentoxid er kemiske forbindelser, der indeholder nitrogen og oxygen. Disse er oxider af nitrogen. De har dog forskellige kemiske og fysiske egenskaber.
Hvad er nitrogenmonoxid?
Nitrogenmonoxid er en uorganisk forbindelse med den kemiske formel NO. Vi kalder det nitrogenoxid, da det er et nitrogenoxid. Det er faktisk et frit radikal, fordi det har en uparret elektron. Desuden er det et heteronukleært diatomisk molekyle.
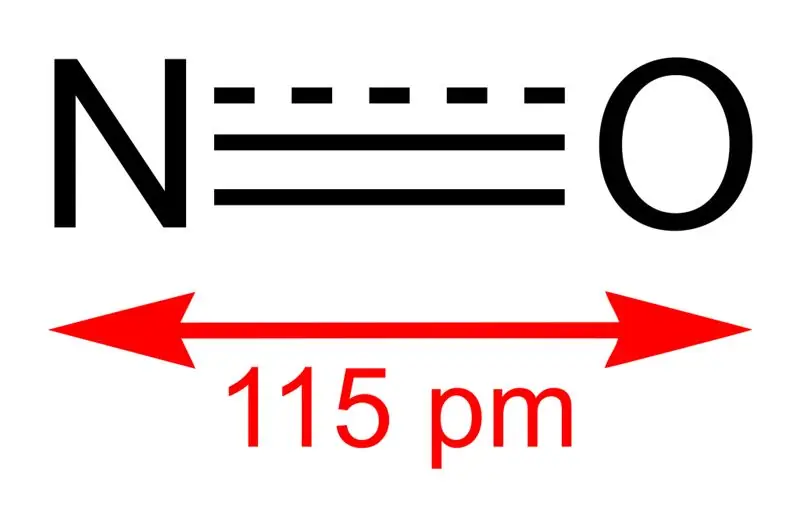
Figur 01: Struktur af nitrogenmonoxid og bindingslængden mellem N og O
Den molære masse af denne forbindelse er 30 g/mol. Det opstår som en farveløs gas. Derudover er dets smeltepunkt -164 °C, mens kogepunktet er -152 °C, hvilket er meget små værdier sammenlignet med andre nitrogenoxider. Vi kan fremstille dette frie radikal via oxidation af ammoniak ved 850 °C i nærværelse af en platinkatalysator. På laboratorieskalaen kan vi dog fremstille det ved at reducere fortyndet salpetersyre med kobber.
Hvad er dinitrogenpentoxid?
Dinitrogenpentoxid er en uorganisk forbindelse med den kemiske formel N2O5 Vi kalder det nitrogenpentoxid. Det er et binært nitrogenoxid. Desuden er det ustabilt og kan fungere som et farligt oxidationsmiddel. Den molære masse af forbindelsen er 108,01 g/mol. Det forekommer en hvid farve fast.
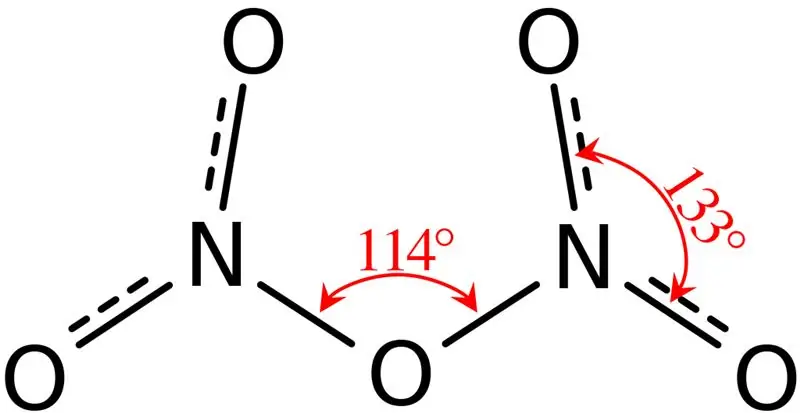
Figur 02: Dinitrogen Pentoxides struktur
Ydermere er smeltepunktet for denne forbindelse 41 °C, og ved 47 °C undergår denne forbindelse sublimering. Denne forbindelse reagerer med vand og giver salpetersyre. Derudover er den molekylære form af dinitrogenpentoxid-molekylet plan. Vi kan fremstille denne forbindelse ved at dehydrere salpetersyre med fosforpentoxid.
Hvad er forskellen mellem nitrogenmonoxid og dinitrogenpentoxid?
Nitrogenmonoxid er en uorganisk forbindelse med den kemiske formel NO, mens dinitrogenpentoxid er en uorganisk forbindelse med den kemiske formel N2O5 Den vigtigste forskel mellem nitrogenmonoxid og dinitrogenpentoxid er, at nitrogenmonoxid er en farveløs gas, mens dinitrogenpentoxid er et hvidt fast stof. Desuden kan vi producere nitrogenmonoxid via oxidation af ammoniak ved 850 °C i nærværelse af en platinkatalysator. Produktionen af dinitrogenpentoxid sker dog via dehydrering af salpetersyre med fosforpentoxid. Når man betragter den molekylære form, er nitrogenmonoxid lineær, mens dinitrogenpentoxid er plan.
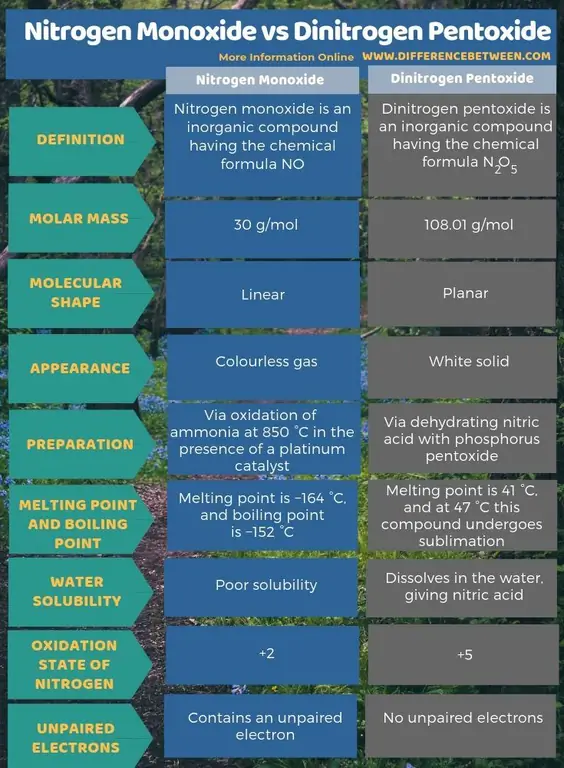
Opsummering – Nitrogenmonoxid vs Dinitrogen Pentoxide
Nitrogenmonoxid er en uorganisk forbindelse med den kemiske formel NO, mens dinitrogenpentoxid er en uorganisk forbindelse med den kemiske formel N2O5 Den vigtigste forskel mellem nitrogenmonoxid og dinitrogenpentoxid er, at nitrogenmonoxid er en farveløs gas, mens dinitrogenpentoxid er et hvidt fast stof.







