Nøgleforskel – alifatiske vs aromatiske kulbrinter
Lad os først kort se, hvilke kulbrinter der diskuterer forskellen mellem alifatiske og aromatiske kulbrinter. Kulbrinter er de organiske forbindelser, der indeholder kulstof- og brintatomer i deres struktur. Den vigtigste forskel mellem alifatiske og aromatiske carbonhydrider er, at alifatiske carbonhydrider ikke indeholder et konjugeret bindingssystem, mens aromatiske carbonhydrider indeholder et konjugeret bindingssystem. Begge disse molekyler betragtes dog som organiske forbindelser.
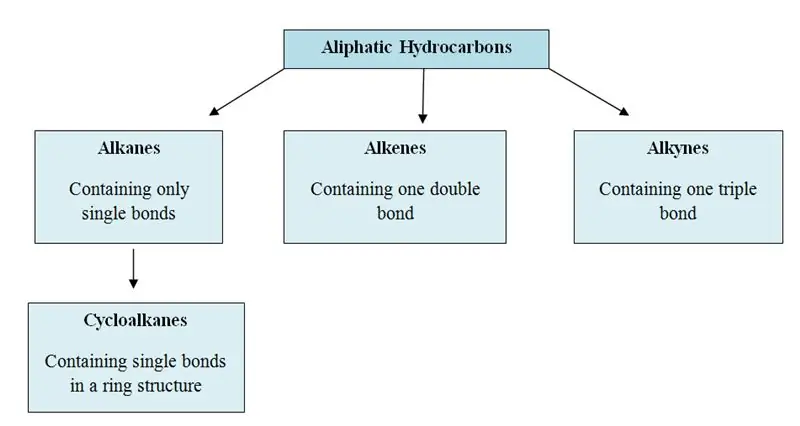
Hvad er alifatiske kulbrinter?
Alifatiske carbonhydrider er de organiske molekyler, der indeholder carbon (C) og hydrogen (H) atomer i deres struktur; i lige kæder, forgrenede kæder eller ikke-aromatiske ringe. Alifatiske kulbrinter kan kategoriseres i tre hovedgrupper; alkaner, alkener og alkyner.
Hvad er aromatiske kulbrinter?
Aromatiske kulbrinter er nogle gange kendt som "arener" eller "arylcarbonhydrider". De fleste aromatiske carbonhydrider indeholder en benzenring i deres struktur; men der er ikke-benzen aromatiske carbonhydrider kaldet heteroarener, som følger "Huckles regel" (cykliske ringe, der følger Huckles regel har 4n+2 antal π-elektroner; hvor n=0, 1, 2, 3, 4, 5, 6). Nogle aromatiske carbonhydrider har mere end én ring; de kaldes polycykliske aromatiske kulbrinter.
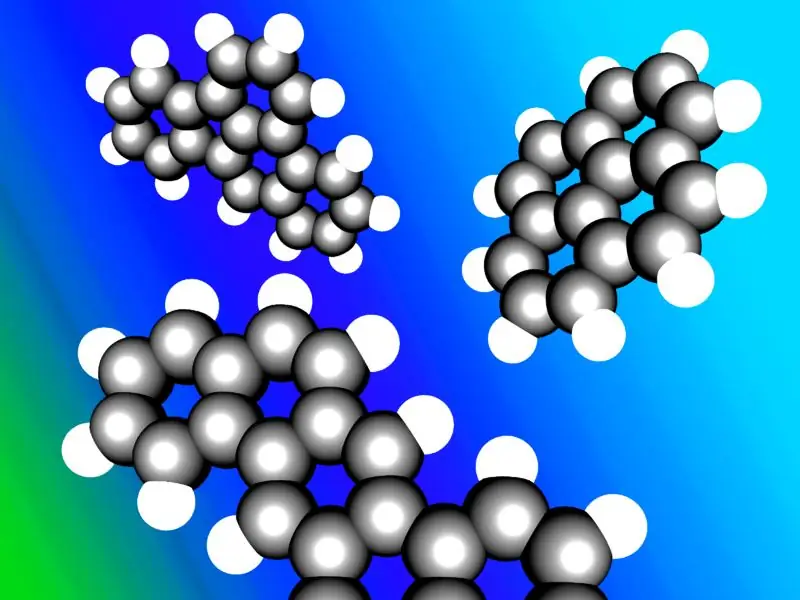
En illustration af typiske polycykliske aromatiske kulbrinter.
Hvad er forskellen mellem alifatiske og aromatiske kulbrinter?
Struktur af alifatiske og aromatiske kulbrinter
Alifatiske kulbrinter: De har lige kæder, forgrenede kæder eller ikke-aromatiske ringe i deres struktur. Denne gruppe har både mættede og umættede kulbrinter. Alkaner er mættede kulbrinter, alkener og alkyner er umættede kulbrinter.
Lige kæder:
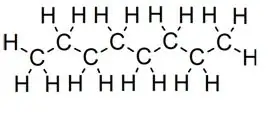
oktan
Mærkekæder:
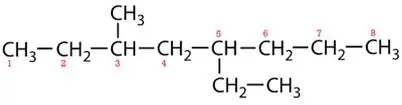
5-ethyl-3-methyloctan

2-methyl-3-pentence
Ikke-aromatiske ringe:
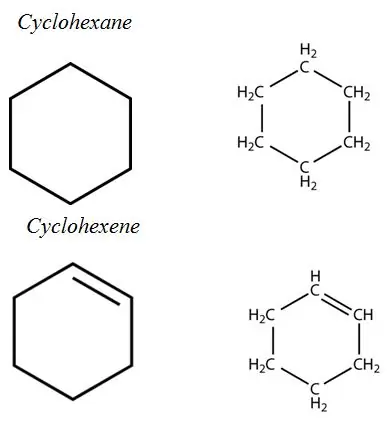
Aromatiske kulbrinter: Aromatiske kulbrinter har et aromatisk ringsystem i deres struktur. De er alle umættede kulbrinter, men relativt stabile på grund af det konjugerede bindingssystem.
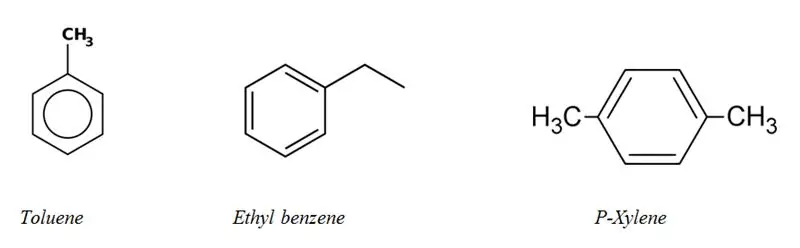
Kategorier af alifatiske og aromatiske kulbrinter
Alifatiske kulbrinter:
Der er tre hovedgrupper i alifatiske kulbrinter; alkaner, alkener og alkyner. De er også kendt som allylcarbonhydrider.
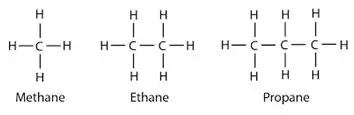
Alkaner: I alkaner er kulstof- og hydrogenatomer bundet sammen med enkeltbindinger. De har ikke flere bindinger. Alkaner danner ringstrukturer, de kaldes cycloalkaner.
Alkener: Denne gruppe indeholder både enkelt- og dobbeltbindinger mellem kulstofatomer. Hydrogen- og kulstofatomer danner altid enkeltbindinger.
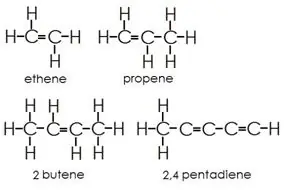
Alkyner: Alkyner har tredobbelte bindinger mellem kulstofatomer ud over enkeltbindinger.
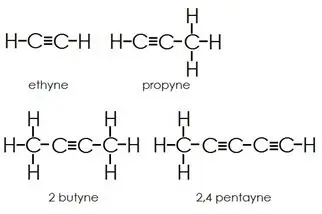
Aromatiske kulbrinter:
De fleste af de aromatiske carbonhydrider indeholder mindst én benzenring i deres struktur. Men der er få ikke-benzen aromatiske kulbrinter, de kaldes "heteroarener". Aromatiske kulbrinter kaldes "aryl" kulbrinter.
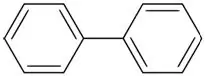
Biphenyl (Et aromatisk carbonhydrid med to benzenringe)
Bindingsmønster for alifatiske og aromatiske kulbrinter
Alifatiske kulbrinter:
I alifatiske kulbrinter; enkelt-, dobbelt- eller tredobbeltbindinger kan eksistere hvor som helst i molekylet. Nogle gange kan der være flere strukturer for en molekylformel ved at ændre positionen af multiple bindinger. Disse molekyler har et lokaliseret elektronsystem.
Aromatiske kulbrinter:
I aromatiske carbonhydrider har de et alternativt enkelt- og dobbeltbindingssystem for at danne et konjugeret bindingssystem for at delokalisere nogle elektroner. (Delokaliserede elektroner kan bevæge sig fra en binding til en anden).
Reaktioner af alifatiske og aromatiske kulbrinter
Alifatiske kulbrinter:
Mættede kulbrinter gennemgår substitutionsreaktioner; umættede carbonhydrider opnår stabiliteten ved additionsreaktion. Men nogle reaktioner sker under kontrollerede forhold uden at bryde flere bindinger.
Aromatiske kulbrinter:
Aromatiske kulbrinter er umættede, men har et stabilt konjugeret elektronsystem, så de er mere tilbøjelige til substitutionsreaktioner frem for additionsreaktioner.
Billede med høflighed: "Polycyclic Aromatic Hydrocarbons" af Inductiveload – Eget arbejde af uploader, Accelrys DS Visualizer. (Public Domain) via Commons







