Nøgleforskellen mellem alfa- og beta-helix afhænger af den type hydrogenbinding, de danner ved udviklingen af disse strukturer. Alfa-spiraler danner intramolekylære hydrogenbindinger, mens beta-spiralerne danner intermolekylære hydrogenbindinger.
Komplekse proteiner har fire strukturelle organisatoriske niveauer – primære, sekundære, tertiære og kvaternære. De sekundære strukturer af proteiner danner peptidkæderne i forskellige orienteringer. Peptidkæderne består af aminosyresekvenser bundet af peptidbindinger. Derfor er der to primære sekundære strukturer i proteiner som alfa-helix og beta-helix. Derudover er der andre sekundære strukturer kaldet beta-sving og hårnålestrukturer. Denne artikel fokuserer hovedsageligt på forskellen mellem alfa- og betahelix.
Hvad er Alpha Helix?
Proteiner har fire strukturelle niveauer af organisation. Af disse er alfa-helixen den mest almindelige sekundære struktur af proteiner. Og denne struktur fremstår som en stang, der er viklet omkring en central akse. Desuden er alfa-helixen en højrehåndshelix. Venstrehåndede helixer kunne dog også være til stede. Her dannes peptidbindingerne fra aminoterminalen til carboxyterminalen. Aminosyrer forbindes med hinanden via disse peptidbindinger. Intramolekylære hydrogenbindinger er hovedårsagen til dannelsen af alfa-helixen.
Figur 01: Alpha Helix
Arrangementet af alfa-helixen afhænger af proteinets hydrofile og hydrofobe natur. Hvis aminosyresekvensen består af et stort antal hydrofile R (variable) grupper, orienterer R-grupperne sig til den vandige fase. Hvis de variable grupper er hydrofobe, vil de stikke ud til den hydrofobe fase af miljøet. I begge scenarier ser R-grupperne ud til at strække sig ud af den spiralformede struktur. På grund af disse strukturelle egenskaber er alpha helix mere modstandsdygtig over for mutationer. Således stabiliserer tilstedeværelsen af hydrogenbindinger alfa-helixens struktur. Der er et gennemsnit på 3,6 rester pr. omdrejning i en alfa-helix, da det tager 3,6 rester for at udvikle brintbindingerne. Nogle strukturelle proteiner såsom kollagen og keratin er rige på alfa-spiraler.
Hvad er Beta Helix?
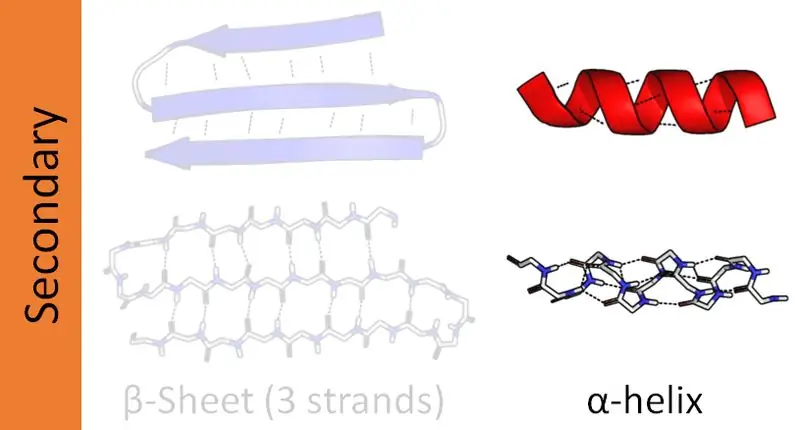
En beta-helix er den næstmest almindelige sekundære struktur af et protein. Selvom det ikke er så almindeligt som alfa-helixen, spiller tilstedeværelsen af beta-helixer også en stor rolle i proteinstrukturen. Dannelsen af beta-helixen foregår via to beta-ark arrangeret enten parallelt eller anti-parallelt. Disse plader dannes derefter til en spiralformet struktur. Intermolekylære hydrogenbindinger mellem to pladestrenge hjælper med dannelsen af en beta-helix.

Figur 02: Beta Helix
Beta-spiraler kan være både højre- eller venstrehåndede afhængigt af deres bindingsmønstre. Når der dannes en beta-helix, vil de variable grupper af de to beta-ark arrangeres inden for kernen af helixen. Derfor har størstedelen af de grupper, der danner beta-ark, hydrofobe funktioner.
I modsætning til alfa-helixen danner 17 rester én omgang i Beta-helixer. Metalioner har evnen til at aktivere dannelsen af Beta helix. I lighed med alfa-helixen understøtter hydrogenbindingerne for at opretholde strukturen af beta-helixen. Kulsyreanhydraseenzym og pectatlyase er to proteiner rige på beta-helixer.
Hvad er lighederne mellem Alpha og Beta Helix?
- Alpha og Beta Helix er to sekundære strukturer af proteiner.
- Aminosyrer er monomererne af begge sekundære strukturer.
- Yderligere er de kemiske bestanddele af alfa- og beta-spiralerne kulstof, brint, oxygen, nitrogen og svovl.
- De to sekundære strukturer udvikler sig også til en organisation på højere niveau.
- Desuden er begge stabiliserede af hydrogenbindinger.
- I begge strukturer er hydrofobiciteten bestemt af tilstedeværelsen af R-grupperne i aminosyrerne.
Hvad er forskellen mellem Alpha og Beta Helix?
Nøgleforskellen mellem alfa- og beta-helixen er den type hydrogenbinding, de viser. Alpha helix viser intramolekylær hydrogenbinding, mens beta helix viser intermolekylær hydrogenbinding. Derudover danner alfa-helixen en højrehåndshelix, mens beta-helixen kan danne både højre- og venstrehåndede helixer. Så dette er også en væsentlig forskel mellem alfa- og beta-helix.
Yderligere er en yderligere forskel mellem alfa- og beta-helix, at alfa-helix-dannelsen finder sted ved vridning af aminosyresekvensen, hvorimod ved beta-helix-dannelse er de to beta-sheets enten parallelle eller anti-parallelle bundet til danner den spiralformede struktur.
Nedenstående infografik viser flere oplysninger om forskellen mellem alfa- og beta-helix.

Oversigt – Alpha vs Beta Helix
Både alfa-spiraler og beta-spiraler er vigtige til at identificere og udlede komplekse proteinstrukturer. Begge typer er sekundære strukturer af proteiner. Alfa-helix er dog et spiralformet twist af aminosyresekvenser. I modsætning hertil sker beta-helixdannelse via hydrogenbinding af parallelle eller anti-parallelle beta-ark. Desuden er hydrogenbindingen intramolekylær i alfa-helixform, mens hydrogenbindingen er intermolekylær i beta-helixform. Desuden har begge disse strukturer en R-gruppe, som bestemmer proteinets hydrofobicitet. Dette opsummerer således forskellen mellem alfa- og beta-helix.







