Nøgleforskellen mellem kulsyre og bikarbonat er, at kulsyre er en neutral kemisk forbindelse, hvorimod bikarbonat er en negativt ladet kemisk forbindelse.
Kulsyre er en svag syre, der dannes i opløsning, når kuldioxid opløses i vand, med den kemiske formel H2CO3. Bicarbonat dannes ved kombinationen af tre oxygenatomer, et hydrogenatom og et kulstofatom med den kemiske formel HCO3-.
Hvad er kulsyre?
Kulsyre er H2CO3. Nogle gange giver vi dette navn til opløsninger med kuldioxid opløst i vand eller kulsyreholdigt vand. Dette skyldes, at kulsyreholdigt vand indeholder en lille mængde H2CO3. Desuden er kulsyre en svag syre, og den kan danne to typer s alte som carbonater og bikarbonater. Molmassen af denne forbindelse er 62,024 g/mol.
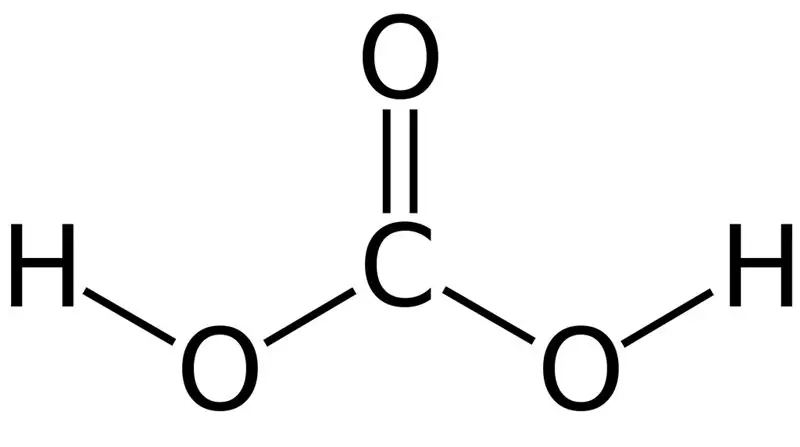
Figur 01: Kulsyrens kemiske struktur
Når kuldioxid opløses i vand, kommer det i en ligevægt mellem kuldioxid og kulsyre. Ligevægten er som følger:
CO2 + H2O ⟷ H2CO3
Hvis vi tilsætter et overskud af kulsyre til en base, giver det bicarbonat. Men hvis der er et overskud af base, har kulsyre en tendens til at give kulsyreholdige s alte. Mere præcist er kulsyre en carboxylsyreforbindelse, der har to hydroxylgruppesubstituenter knyttet til carbonylcarbonet. Desuden er det en polyprotisk syre, som er i stand til at donere protoner. Den har to aftagelige protoner, så den er specifikt diprotisk.
Hvad er bikarbonat?
Bicarbonat dannes ved kombinationen af tre oxygenatomer, et hydrogenatom og et carbonatom. Produktet af denne kombination kan være en ion eller en forbindelse med flere elektroner end protoner. Vi kan beskrive det som en kemisk art med den kemiske formel HCO3–.
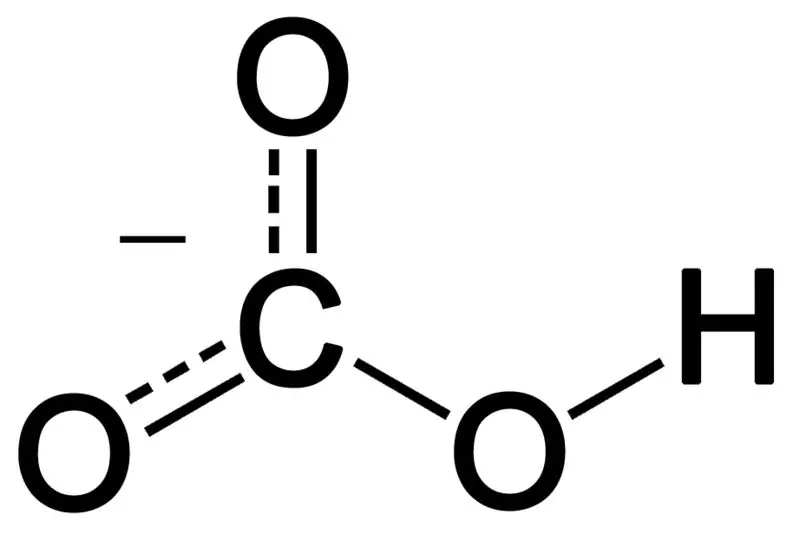
Figur 02: Den kemiske struktur af bikarbonatanion
Denne forbindelse er en afgørende del af kroppens pH-buffersystem, i lægmandstermer: den er ansvarlig for at holde ens blod i en tilstand, der ikke er for sur eller for basisk. Derudover fungerer det som en måde at holde fordøjelsessafterne i skak, når maven er færdig med at fordøje maden. Desuden danner kulsyre i regnvand bikarbonationer, når det rammer sten. Denne strøm af bikarbonationer er vigtig for at holde kulstofkredsløbet i gang.
Hvad er forskellen mellem kulsyre og bikarbonat?
Kulsyre er en svag syre, der dannes i opløsning, når kuldioxid opløses i vand, og dens kemiske formel er H2CO3. Bicarbonat dannes ved kombinationen af tre oxygenatomer, et hydrogenatom og et kulstofatom med den kemiske formel HCO3-. Den vigtigste forskel mellem kulsyre og bikarbonat er, at kulsyre er en neutral kemisk forbindelse, mens bikarbonat er en negativt ladet kemisk forbindelse. Desuden bruges kulsyre til fremstilling af boblende, sovende drikke, behandling af dermatitider, i mundskyl osv., mens bikarbonat bruges i fødevarepræparater såsom bagning (som hævemiddel), og det giver evnen til at modstå ændringer i pH.
Den følgende infografik opsummerer forskellen mellem kulsyre og bikarbonat i tabelform til sammenligning side om side.
Opsummering – Kulsyre vs bikarbonat
Kulsyre er H2CO3. Bicarbonat dannes ved kombinationen af tre oxygenatomer, et hydrogenatom og et kulstofatom, med den kemiske formel HCO3-. Den vigtigste forskel mellem kulsyre og bikarbonat er, at kulsyre er en neutral kemisk forbindelse, hvorimod bikarbonat er en negativt ladet kemisk forbindelse.







