Nøgleforskellen mellem KH2PO4 og K2HPO4 er, at KH2PO4 er monobasisk og kan frigive en lav mængde kalium, mens K2HPO4 er dibasisk og kan frigive en høj mængde kalium, når den bruges i gødning.
Begreberne monobasisk og dibasisk refererer til antallet af kaliumkationer bundet til fosfatmolekylet. Med andre ord kan en monobasisk forbindelse kun optage én hydrogenion eller proton, mens en dibasisk forbindelse kan optage op til to hydrogenioner eller protoner.
Hvad er KH2PO4?
KH2PO4 er monokaliumphosphat. Det er også kendt som MKP, kaliumdihydrogenphosphat, KDP eller monobasisk kaliumphosphat. Det er en uorganisk forbindelse, der ofte bruges som gødning sammen med dikaliumfosfat. De tre hovedanvendelser af KH2PO4 er produktion af gødning, som fødevaretilsætningsstof i fødevareindustrien og som buffer. Desuden kan vi observere, at dette s alt gennemgår cokrystallisation med dikaliums alt og også med phosphorsyre. Vi kan dog se, at der er enkeltkrystaller af KH2PO4, der er paraelektriske ved stuetemperatur. De kan blive ferroelektriske ved lave temperaturer. I sin kommercielt tilgængelige form er KH2PO4 et hvidt pulver, der er udflydende.

Figur 01: Udseende af KH2PO4
KH2PO4 kan eksistere i forskellige polymorfe strukturer. Ved stuetemperatur forekommer KH2PO4 i paraelektrisk krystalform med tetragonal symmetri. Ved lave temperaturer kan det omdannes til ferroelektriske krystalformer med ortorombisk symmetri. Desuden kan opvarmning af stoffet til en høj temperatur forårsage dannelse af monoklinisk KH2PO4. Ved yderligere opvarmning kan dette stof omdannes til kaliummetaphosphat KPO3 gennem nedbrydning af KH2PO4.
Når vi overvejer produktionen af KH2PO4, kan vi producere det ved at omsætte fosforsyre på kaliumcarbonat.
Hvad er K2HPO4?
K2HPO4 er dikaliumphosphat. De andre navne for denne forbindelse er dikaliumhydrogenorthophosphat og dibasisk kaliumphosphat. Det er en uorganisk forbindelse, der er nyttig i gødningsproduktion, som fødevaretilsætningsstof og som buffer. Dette stof fremstår som et hvidt eller farveløst fast stof, som er vandopløseligt.

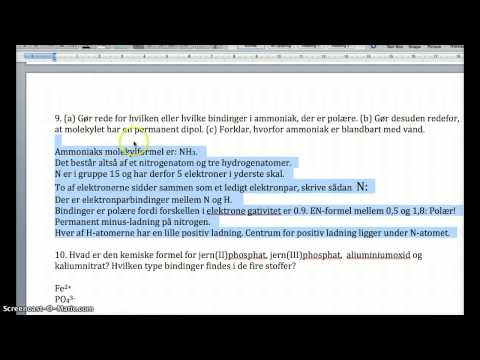
Figur 02: Udseende af K2HPO4
I kommerciel skala kan vi producere K2HPO4 ved delvis neutralisering af fosforsyre ved hjælp af to ækvivalenter kaliumchloridforbindelse.
Vi kan bruge K2HPO4 som et fødevaretilsætningsstof i efterligning af mælkecreme, tørre pulverdrikke, miner altilskud og starterkulturer. Derudover kan den fungere som en emulgator, en stabilisator og som en teksturizer, et buffermiddel, chelateringsmidler specifikt til calcium i mælkeprodukter osv.
Hvad er lighederne mellem KH2PO4 og K2HPO4?
- KH2PO4 og K2HPO4 er nyttige i gødningsproduktion.
- Begge fremstår som et hvidt pulver, der er væskende.
- De er vandopløselige.
Hvad er forskellen mellem KH2PO4 og K2HPO4?
Begreberne monobasisk og dibasisk refererer til antallet af kaliumkationer bundet til fosfatmolekylet. Den vigtigste forskel mellem KH2PO4 og K2HPO4 er, at KH2PO4 er monobasisk, så den kan frigive en lav mængde kalium, mens K2HPO4 er dibasisk, så den kan frigive en høj mængde kalium, når den bruges i gødning. Desuden kan monobasisk KH2PO4-forbindelse kun tage én hydrogenion eller proton fra sin opløsning, hvorimod dibasisk K2HPO4-forbindelse har to kaliumioner, der kan ombyttes til to hydrogenioner eller protoner.
Den følgende infografik præsenterer forskellene mellem KH2PO4 og K2HPO4 i tabelform.
Oversigt – KH2PO4 vs K2HPO4
Udtrykkene monobasisk og dibasisk refererer til antallet af kaliumkationer bundet til fosfatmolekylet. Den vigtigste forskel mellem KH2PO4 og K2HPO4 er, at KH2PO4 er monobasisk og kan frigive en lav mængde kalium, hvorimod K2HPO4 er dibasisk og kan frigive en høj mængde kalium, når den bruges i gødning.