Nøgleforskellen mellem carben og carbanion er, at carbenet har et divalent carbonatom, hvorimod carbanionen har et trivalent carbonatom.
Carben og carbanion er organiske molekyler, der indeholder kulstof og brint eller andre atomer. Disse to typer organiske forbindelser er forskellige fra hinanden i deres form, geometri, valens, oxidationstilstand, ladning osv. Så denne artikel behandler forskellen mellem carben og carbanion på disse aspekter.
Hvad er Carbene?
Et carben er et organisk molekyle med et neutr alt kulstofatom med en valens på to. Med andre ord indeholder carbonatomet i en carbenforbindelse to ikke-delte valenselektroner. Den generelle kemiske formel for denne type forbindelse er R-(C:)-R' eller R=C: hvor R og R' repræsenterer substituenter eller hydrogenatomer. Den generelle struktur af denne forbindelse er som følger:

Figur 01: Carbens kemiske struktur
Desuden er der to klasser af carbener som singlet-carben og triplet-carben. Singlet-carbenforbindelserne er spin-parrede forbindelser. Disse molekyler vedtager en sp2 hybridstruktur. Triplet-carbenforbindelser har uparrede elektroner. De fleste carbenforbindelser har en tripletstruktur i deres grundtilstand, undtagen carbenforbindelser, der indeholder nitrogen-, oxygen- eller svovlatomer.
Vi kan kalde en carbenforbindelse for en singlet- eller tripletstruktur afhængigt af disse molekylers elektroniske spins. For eksempel er triplet-carbenforbindelser paramagnetiske, og vi kan observere denne struktur ved elektronspin-resonansspektroskopi, hvis vi kan få disse molekyler til at vare længe nok til analysen. Desuden er spin af singlet carben molekyler nul, mens spin af triplet carben molekyler er et. Ud over disse er singlet-carben-molekyler stabile i et vandigt medium, hvorimod triplet-carben-molekyler er stabile i en gasformig tilstand.
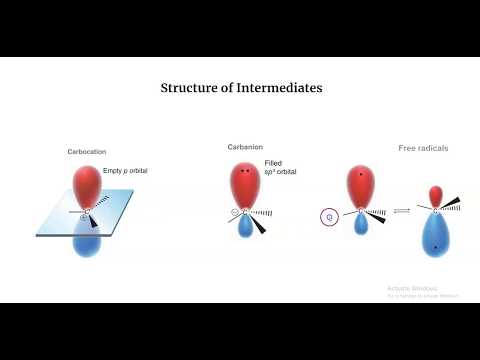
Hvad er Carbanion?
En carbanion er en anion med et trivalent carbonatom og en netto negativ ladning på ionen. Et trivalent carbonatom er en ion, der indeholder et carbonatom, der har dannet tre kovalente bindinger. For at betegne en forbindelse som en carbanion skal den have en formel negativ ladning i mindst én resonansstruktur.

Figur 02: Carbanions resonansstrukturer
Yderligere har en carbanion ingen pi-elektrondelokalisering, og disse molekyler antager en trigonal pyramideformet, bøjet eller lineær geometri, når carbanionen har henholdsvis tre, to eller én substituent. Endnu vigtigere er, at en carbanion er den konjugerede base af en kulsyre.
Karbanioner er typisk nukleofile og basale. Nukleofilicitet og basiciteten af disse forbindelser kan bestemmes af typen af substituenter på carbonatomet. Desuden kan der også være chirale karbanioner.
Yderligere gør elektrondensiteten på det negativt ladede carbonatom i en carbanion ionen i stand til at reagere med elektrofiler med varierende styrker, herunder carbonylgrupper, halogenerede reagenser osv.
Hvad er forskellen mellem Carbene og Carbanion?
Carben og carbanion er organiske molekyler, der indeholder kulstof og brint eller andre atomer. Den vigtigste forskel mellem carben og carbanion er, at carben har et divalent carbonatom, mens carbanion har et trivalent carbonatom. Derfor har carbenforbindelser kulstofatomer med to kovalente kemiske bindinger, mens carbanionforbindelser har tre kovalente bindinger på kulstofatomet og også en formel negativ ladning.
Infografikken nedenfor opsummerer forskellene mellem carben og carbanion.

Opsummering – Carbene vs Carbanion
Carben og carbanion er organiske molekyler, der indeholder kulstof og brint eller andre atomer. Den vigtigste forskel mellem carben og carbanion er, at carben har et divalent carbonatom, hvorimod carbanion har et trivalent carbonatom.