Nøgleforskellen mellem lokaliserede og delokaliserede elektroner er, at lokaliserede elektroner er placeret mellem atomer, hvorimod delokaliserede elektroner er placeret over og under atomer.
Generelt kemi er lokaliserede elektroner og delokaliserede elektroner udtryk, der beskriver kemiske strukturer af kemiske forbindelser. Lokaliserede elektroner er bindingselektronerne i molekyler, mens delokaliserede elektroner er ikke-bindende elektroner, der forekommer som elektronskyer over og under molekylet.
Hvad er lokaliserede elektroner?
Lokaliserede elektroner er bindingselektronerne i kemiske forbindelser. Disse elektroner er placeret mellem atomer, hvor sigma-bindinger kan findes. Sigmabindinger er bindingerne dannet af den aksiale overlapning af halvfyldte atomorbitaler af atomer.
Derfor forekommer lokaliserede elektroner i kovalente forbindelser med kovalente kemiske bindinger. Disse lokaliserede elektroner tilhører to bestemte atomer, i modsætning til delokaliserede elektroner, som er fælles for alle atomerne i molekylet. Lokaliserede elektroner deles mellem atomer, der danner kovalente bindinger, koordinationsbindinger osv.
Hvad er delokaliserede elektroner?
Delokaliserede elektroner er de ikke-bindende elektroner i kemiske forbindelser. Dette udtryk refererer til elektroner, der ikke er forbundet med et enkelt atom eller en kovalent binding. Imidlertid har udtrykket delokaliseret elektron forskellige betydninger på forskellige områder. For eksempel i organisk kemi er delokaliserede elektroner i resonansstrukturerne af konjugerede systemer i aromatiske forbindelser. I faststoffysik er delokaliserede elektroner de frie elektroner, der letter elektrisk ledning. Desuden bruger kvantefysik udtrykket delokaliserede elektroner til at henvise til molekylære orbitale elektroner, der har strakt sig over flere atomer.

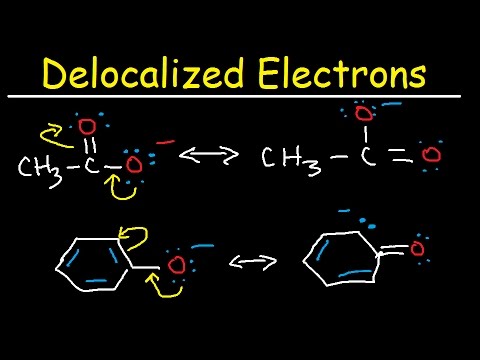
Figur 01: Benzen, (delokalisering af elektronerne er angivet med cirklen)
Bzenringen er det enkleste eksempel på et aromatisk system med delokaliserede elektroner. Der er seks pi-elektroner i benzenmolekylet; vi angiver disse ofte grafisk ved hjælp af en cirkel. Denne cirkel betyder, at pi-elektronerne er forbundet med alle atomerne i molekylet. Denne delokalisering får benzenringen til at have kemiske bindinger med lignende bindingslængder.
Hvad er forskellen mellem lokaliserede og delokaliserede elektroner?
Vi bruger termer lokaliserede og delokaliserede elektroner under grenen af generel kemi, vedrørende den kemiske struktur af forbindelser. Et lokaliseret atom er en elektron, der tilhører et bestemt atom, mens en delokaliseret elektron er en elektron, der ikke er forbundet med et enkelt atom eller en enkelt kovalent binding. Den vigtigste forskel mellem lokaliserede og delokaliserede elektroner er, at lokaliserede elektroner er placeret mellem atomer, mens delokaliserede elektroner er placeret over og under atomerne. Med andre ord er lokaliserede elektroner begrænset til et bestemt område mellem to atomer, mens delokaliserede elektroner er spredt over flere atomer.
En anden væsentlig forskel mellem lokaliserede og delokaliserede elektroner er desuden, at de lokaliserede elektroner er forbundet med bestemte atomer i en forbindelse, mens de delokaliserede elektroner er forbundet med alle atomerne i molekylet. Desuden er lokaliserede elektroner grafisk angivet med rette linjer, mens delokaliserede elektroner er grafisk angivet med cirkler.
Den følgende tabel opsummerer forskellene mellem lokaliserede og delokaliserede elektroner.

Oversigt – lokaliseret og delokaliseret elektron
Begreberne lokaliserede og delokaliserede elektroner diskuteres under generel kemi. Den vigtigste forskel mellem lokaliserede og delokaliserede elektroner er, at lokaliserede elektroner er placeret mellem atomer, mens delokaliserede elektroner er placeret over og under atomerne. Desuden er delokaliserede elektroner forbundet med bestemte atomer i en forbindelse, mens de delokaliserede elektroner er forbundet med alle atomerne i molekylet.