Nøgleforskellen mellem koncentrationscelle og kemisk celle er, at i koncentrationsceller er sammensætningen af to halvceller ens, hvorimod sammensætningerne i de kemiske celler kan eller måske ikke ligner hinanden.
Koncentrationscelle er en type elektrokemisk celle. Der er to typer elektrokemiske celler eller kemiske celler som galvaniske celler og elektrolytiske celler. Koncentrationscellen er en type galvanisk celle.
Hvad er en koncentrationscelle?
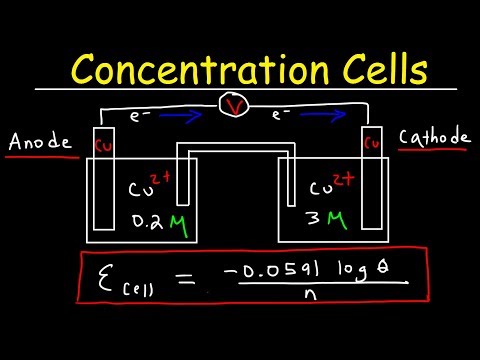
Koncentrationscelle er en type galvanisk celle, hvor de to halvceller i cellen er ens i sammensætning. Derfor siger vi, at de to halve celler er ækvivalente. De adskiller sig kun i koncentration. Spændingen produceret af denne celle er meget lille, da denne celle har tendens til at opnå en ligevægtstilstand. Ligevægten kommer, når koncentrationerne af de to halvceller bliver lige store.

Koncentrationscellen producerer elektricitet via reduktionen af systemets termodynamiske frie energi. Da sammensætningen af halvcellerne er ens, sker den samme reaktion, men i modsatte retninger. Så denne proces øger koncentrationen af cellen med lavere koncentration og reducerer koncentrationen af cellen med højere koncentration. Når elektriciteten strømmer, genereres termisk energi. Cellen optager denne energi som varme. Der er to typer koncentrationsceller som følger:
- Elektrolytkoncentrationscelle – elektroderne består af det samme stof, og halvcellerne indeholder den samme elektrolyt med forskellige koncentrationer
- Elektrodekoncentrationscelle – to elektroder (af samme stof) med forskellige koncentrationer dyppes i den samme elektrolyt
Hvad er en kemisk celle
En kemisk celle, mere præcist en elektrokemisk celle, er et system (en enhed), der kan producere elektrisk energi gennem spontane kemiske reaktioner. De kemiske reaktioner, der er involveret i denne proces, kaldes redoxreaktioner. Disse reaktioner sker gennem overførsel af elektroner mellem kemiske arter. Desuden har en redoxreaktion to halvreaktioner kendt som oxidationsreaktion og reduktionsreaktion. Mens oxidationsreaktioner altid frigiver elektroner til systemet, tager reduktionsreaktioner elektroner fra systemet. Således kan vi sige, at de to halvreaktioner sker samtidigt.
Der er to typer elektrokemiske celler som voltaiske (galvaniske) celler og elektrolytiske celler. En elektrokemisk celle er sammensat af to halve celler. Halvreaktionerne forekommer i disse to halvceller. Desuden forårsager de kemiske reaktioner, der finder sted i en celle, opbygningen af en potentialforskel mellem to halvceller.

Figur 01: En simpel galvanisk celle
En halvcelle består generelt af en elektrode og en elektrolyt. Derfor har en komplet elektrokemisk celle to elektroder og to elektrolytter; de to halvceller kan nogle gange bruge den samme elektrolyt. Hvis der er to forskellige elektrolytter, så bruges en s altbro til at opretholde kontakten mellem elektrolytterne. Og dette gøres ved at lave en passage for at overføre ioner gennem s altbroen. Elektronerne strømmer fra den ene halvcelle til den anden gennem et eksternt kredsløb. Vi kalder disse to elektroder anode og katode.
Yderuden forekommer oxidations- og reduktionsreaktioner i to elektroder separat. Mens oxidationsreaktionen finder sted i anoden, sker reduktionsreaktionen i katoden. Derfor produceres elektroner i anoden, og de bevæger sig fra anoden til katoden gennem det eksterne kredsløb. S altbroen hjælper med at holde systemet neutr alt (elektrisk) ved at overføre ioner gennem det for at afbalancere de elektriske ladninger.
Hvad er forskellen mellem koncentrationscelle og kemisk celle?
Koncentrationscelle er en type elektrokemisk celle. Der er to typer kemiske celler; de er de galvaniske celler og elektrolytiske celler. Koncentrationscellen er en type galvanisk celle. Nøgleforskellen mellem koncentrationscelle og kemisk celle er, at i koncentrationsceller er sammensætningen af to halvceller ens, mens sammensætningerne i kemiske celler kan være ens eller ikke.
Nedenfor er en oversigt over forskellen mellem koncentrationscelle og kemisk celle.

Opsummering – koncentrationscelle vs kemisk celle
Koncentrationscelle er en type elektrokemisk celle. Der er to typer kemiske (elektrokemiske) celler, som galvaniske celler og elektrolytiske celler. For at være præcis er en koncentrationscelle en type galvanisk celle. Den vigtigste forskel mellem koncentrationscelle og kemisk celle er, at i koncentrationsceller er sammensætningen af to halvceller ens, hvorimod sammensætningerne i kemiske celler kan eller måske ikke ligner hinanden.