Nøgleforskel – oxygeneret vs deoxygeneret hæmoglobin
Hemoglobin er et protein, der findes i røde blodlegemer, som transporterer ilt fra lungerne til kroppens væv og organer og kuldioxid fra kropsvæv og organer til lungerne. Der er to tilstande af hæmoglobin: iltet og deoxygeneret hæmoglobin. Den vigtigste forskel mellem iltet og deoxygeneret hæmoglobin er, at iltet hæmoglobin er tilstanden af hæmoglobin bundet med fire iltmolekyler, mens det deoxygenerede hæmoglobin er den ubundne tilstand af hæmoglobin med ilt. Oxygeneret hæmoglobin er lys rød i farven, mens deoxygeneret hæmoglobin er mørkerød i farven.
Hvad er hæmoglobin?
Hemoglobin (Hb) er et komplekst proteinmolekyle, der findes i røde blodlegemer, som giver den typiske form til de røde blodlegemer (rundt med sm alt centrum). Nøglerollerne for Hb inkluderer transport af ilt fra lungerne til kropsvævene, udskiftning af det med kuldioxid og at tage kuldioxid fra kropsvævene til lungen og udskifte tilbage med oxygen. Hæmoglobinmolekylet indeholder fire polypeptidkæder (proteinunderenheder) og fire hæmgrupper som vist i figur 01. Fire polypeptidkæder repræsenterer to alfa-globulinkæder og to beta-globulinkæder. Hæm er en vigtig porphyrinforbindelse i hæmoglobinmolekylet, som har et centr alt jernatom indlejret indeni. Hver polypeptidkæde i hæmoglobinmolekylet indeholder en hæmgruppe og et jernatom. Jernatomet er afgørende for transporten af ilt og kuldioxid i blodet, og det er den vigtigste bidragyder til rød farve på de røde blodlegemer. Hæmoglobin kaldes også som et mettaloprotein på grund af dets inkorporering af jernatomer.
Oxygentilførsel til væv og organer er vital og afgørende. Celler opnår energi gennem aerob respiration (oxidativ phosphorylering) ved hjælp af oxygen som elektronacceptor. Produktion af energi er nødvendig for optimal cellemetabolisme og -funktioner. Iltforsyningen lettes af hæmoglobinproteinerne. Derfor er hæmoglobin også kendt som iltbærende protein i blodet.
Det lave niveau af hæmoglobin i blodet kaldet anæmi. Anæmi kan forårsage flere sygdomme. Der er forskellige årsager til lave hæmoglobinkoncentrationer i blodet. Mangel på jern er hovedårsagen, mens overdreven slankekure, usund livsstil, nogle sygdomme og kræftformer også er årsager til det samme.
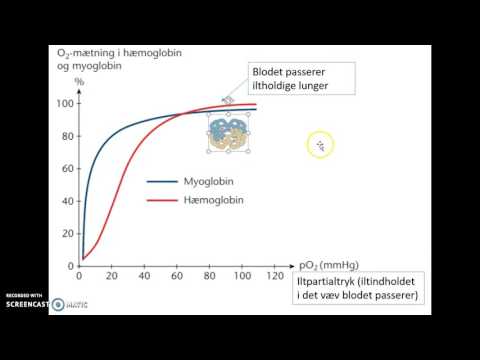
Hemoglobinmolekyle har fire oxygenbindingssteder forbundet med fire Fe+2-atomer. Et molekyle hæmoglobin kan maksim alt bære fire molekyler ilt. Derfor kan hæmoglobin være mættet eller umættet med ilt. Iltmætning er procentdelen af iltbindingssteder for hæmoglobin optaget af ilten. Med andre ord måler den fraktionen af oxygenmættet hæmoglobin i forhold til total hæmoglobin. Disse to tilstande af hæmoglobin er kendt som iltet og deoxygeneret hæmoglobin.

Figur 1: Struktur af hæmoglobin
Hvad er iltet hæmoglobin?
Når hæmoglobinmolekyler er bundet og mættet med oxygenmolekyler, er kombinationen af hæmoglobin med oxygen kendt som oxygeneret hæmoglobin (oxyhæmoglobin). Oxygeneret hæmoglobin dannes under den fysiologiske respiration (ventilation), når iltmolekyler binder sig med hæmoglobingrupper i røde blodlegemer. Oxygeneret hæmoglobinproduktion sker hovedsageligt i lungekapillærerne tæt på alveolerne i lungerne, hvor gasudvekslingen finder sted (indånding og udånding). Affiniteten af oxygenbinding til hæmoglobinet er stærkt påvirket af pH. Når pH-værdien er høj, er der en høj affinitet for binding af oxygen til hæmoglobin, men den falder, når pH-værdien falder. Der er norm alt en høj pH i lungerne og en lav pH i musklerne. Denne forskel i pH-forhold er således nyttig til iltbinding, transport og frigivelse. Da der er en høj bindingsaffinitet nær lungen, binder ilt sig til hæmoglobin og danner oxyhæmoglobin. Når oxyhæmoglobin når musklen på grund af lav pH, opløses det og frigiver ilt til cellerne. Norm alt iltniveau i menneskers blod anses for at være i intervallet 95 – 100 %. Iltet blod er synligt i lys rød (karminrød) farve. Når hæmoglobinet er i iltet form, er det også kendt som R-tilstand (afslappet tilstand) af hæmoglobinet.

Figur 2: Iltet hæmoglobin
Hvad er deoxygeneret hæmoglobin?
Deoxygeneret hæmoglobin er den form for hæmoglobin, der ikke er bundet til ilt. Deoxygeneret hæmoglobin mangler ilt. Derfor kaldes denne tilstand T-tilstand (spændt tilstand) af hæmoglobin. Deoxygeneret hæmoglobin kan observeres, når iltet hæmoglobin frigiver ilt, og det udveksles med kuldioxid nær plasmamembranen af muskelceller, hvor der er et lavt pH-miljø. Når hæmoglobin har en lav affinitet til iltbindingen, afgiver det ilt og omdannes til deoxygeneret hæmoglobin.

Figur 3: Oxygeneret og deoxygeneret blod strømmer gennem kroppen
Hvad er forskellen mellem iltet og deoxygeneret hæmoglobin?
Oxygeneret vs. Deoxygeneret hæmoglobin |
|
| Oxygeneret hæmoglobin er kombinationen af hæmoglobin plus ilt. | Den ubundne form for hæmoglobin med oxygen er kendt som deoxygeneret hæmoglobin. |
| Oxygen-molekylets tilstand | |
| Oxygenmolekyler er bundet til hæmoglobinmolekyle. | Oxygenmolekyler er ikke bundet til hæmoglobinmolekyle. |
| Farve | |
| Oxygeneret hæmoglobin er lys rød i farven. | Deoxygeneret hæmoglobin er mørkerød i farven. |
| Hemoglobintilstand | |
| Dette er kendt som R-tilstanden af hæmoglobin. | Dette er kendt som T (spændt) tilstand af hæmoglobin. |
| Formation | |
| Oxygeneret hæmoglobin dannes, når iltmolekyler binder til hæmoglobingrupper i røde blodlegemer under den fysiologiske respiration. | Deoxygeneret hæmoglobin dannes, når ilt frigives fra iltet hæmoglobin og udveksles med kuldioxid nær plasmamembranen af muskelceller. |
Oversigt – Oxygeneret og deoxygeneret hæmoglobin
Hemoglobin er et livsvigtigt protein, der findes i røde blodlegemer, og som er i stand til at transportere ilt fra lungerne til kropsvæv og bringe kuldioxid fra kropsvæv til lungerne. Der er to tilstande af hæmoglobin på grund af binding af ilt. Det er iltet hæmoglobin og deoxygeneret hæmoglobin. Oxygeneret hæmoglobin dannes, når iltmolekyler bindes til Fe-atomerne. Deoxygeneret hæmoglobin dannes, når iltmolekyler frigives fra hæmoglobinmolekylet. Dette er den vigtigste forskel mellem iltet og deoxygeneret hæmoglobin. Ilttilhæftning og -frigivelse er hovedsageligt påvirket af iltens pH og parti altryk.