Nøgleforskel – Trypsin vs Chymotrypsin
Proteinfordøjelse er en meget vigtig proces i den overordnede fordøjelsesprocedure i levende organismer. Komplekse proteiner fordøjes til dets monomerer af aminosyrer og absorberes via tyndtarmen. Proteiner er essentielle, da de tjener en vigtig funktionel og en strukturel rolle i en organisme. Proteinfordøjelse foregår via proteinfordøjelsesenzymer, som inkluderer trypsin, chymotrypsin, peptidaser og proteaser. Trypsin er et protein-fordøjende enzym, som sp alter peptidbindingen ved de basiske aminosyrer, som inkluderer lysin og arginin. Chymotrypsin er også et protein-fordøjende enzym, som sp alter peptidbindingen ved aromatiske aminosyrer såsom phenylalanin, tryptophan og tyrosin. Den vigtigste forskel mellem trypsin og chymotrypsin er positionen af aminosyren, hvori den sp alter i proteinet. Trypsin sp alter ved basiske aminosyrepositioner, mens chymotrypsin sp alter ved aromatiske aminosyrepositioner.
Hvad er trypsin?
Trypsin er et 23,3 kDa protein, der tilhører familien af serinproteaser, og dets hovedsubstrater er basiske aminosyrer. Disse basiske aminosyrer omfatter arginin og lysin. Trypsin blev opdaget i 1876 af Kuhne. Trypsin er et kugleformet protein og eksisterer i sin inaktive form, som er trypsinogen - zymogen. Virkningsmekanismen for trypsin er baseret på serinproteaseaktiviteten.
Trypsin sp alter i den C-terminale ende af de basiske aminosyrer. Dette er en hydrolysereaktion og finder sted ved en pH - 8,0 i tyndtarmen. Aktiveringen af trypsinogen sker gennem fjernelse af det terminale hexapeptid, og det producerer den aktive form; trypsin. Aktiv trypsin er af to hovedtyper; α – trypsin og β-trypsin. De adskiller sig i deres termiske stabilitet og deres struktur. Det aktive sted for trypsin indeholder histidin (H63), asparaginsyre (D107) og serin (S200).

Figur 01: Trypsin
Den enzymatiske virkning af trypsin hæmmes af DFP, aprotinin, Ag+, Benzamidin og EDTA. Anvendelsen af trypsin omfatter dissociation af væv, trypsinisering i dyrecellekulturer, tryptisk kortlægning, in vitro proteinundersøgelser, fingeraftryk og i vævskulturapplikationer.
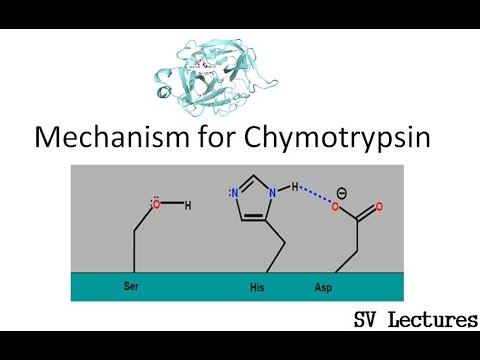
Hvad er Chymotrypsin?
Chymotrypsin har en molekylvægt på 25,6 kDa og tilhører serinproteasefamilien, og det er en endopeptidase. Chymotrypsin eksisterer i sin inaktive form, som er chymotrypsinogen. Chymotrypsin blev opdaget i år 1900-tallet. Chymotrypsin hydrolyserer peptidbindingerne ved de aromatiske aminosyrer. Disse aromatiske substrater omfatter tyrosin, phenylalanin og tryptofan. Substraterne af dette enzym er hovedsageligt i L-isomererne og virker let på amider og estere af aminosyrer. Den optimale pH-værdi, hvori chymotrypsin virker, er 7,8 – 8,0. Der er to hovedformer for chymotrypsin, såsom chymotrypsin A og chymotrypsin B, og de adskiller sig lidt i deres strukturelle og proteolytiske egenskaber. Det aktive sted for chymotrypsin indeholder en katalytisk triade og er sammensat af histidin (H57), asparaginsyre (D102) og serin (S195).

Figur 02: Chymotrypsin
Aktivatorerne af chymotrypsin er Cetyltrimethylammoniumbromid, Dodecyltrimethylammoniumbromid, Hexadecyltrimethylammoniumbromid og Tetrabutylammoniumbromide. Inhibitorerne af chymotrypsin er peptidylaldehyder, boronsyrer og coumarinderivater. Chymotrypsin bruges kommercielt i peptidsyntese, peptidkortlægning og peptidfingeraftryk.
Hvad er lighederne mellem trypsin og chymotrypsin?
- Begge enzymer er serinproteaser.
- Begge enzymer sp alter peptidbindinger.
- Begge enzymer virker i tyndtarmen.
- Begge enzymer eksisterer i sin inaktive form som zymogener.
- Begge enzymer er sammensat af en katalytisk triade, der indeholder histidin, asparaginsyre og serin på dets aktive sted.
- Begge enzymer blev oprindeligt opdaget og udvundet fra kvæg.
- Produktion af begge enzymer sker i øjeblikket gennem rekombinante DNA-teknikker.
- Begge enzymer virker på en optimal basisk pH.
- Begge enzymer bruges in vitro i forskellige industrier.
Hvad er forskellen mellem trypsin og chymotrypsin?
Trypsin vs Chymotrypsin |
|
| Trypsin er et protein-fordøjende enzym, som vil sp alte peptidbindingen ved de basiske aminosyrer såsom lysin og arginin. | Chymotrypsin, som også er et protein-fordøjende enzym, sp alter peptidbindingen ved aromatiske aminosyrer såsom phenylalanin, tryptophan og tyrosin. |
| Molekylvægt | |
| Trypsins molekylvægt er 23,3 k Da. | Molekylvægten af chymotrypsin er 25,6 k Da. |
| Substrates | |
| Komplekse proteiner fordøjes til dets monomerer af aminosyrer og absorberes via tyndtarmen. | Aromatiske aminosyresubstrater såsom tyrosin, tryptofan og phenylalanin virker på chymotrypsin. |
| Zymogen Form of the Enzyme | |
| Trypsinogen er den inaktive form for trypsin. | Chymotrypsinogen er den inaktive form af chymotrypsin. |
| Aktivatorer | |
| Lanthanider er aktivatorer af trypsin. | Cetyltrimethylammoniumbromid, Dodecyltrimethylammoniumbromid, Hexadecyltrimethylammoniumbromid og Tetrabutylammoniumbromid er aktivatorer af chymotrypsin. |
|
Inhibitors |
|
| DFP, aprotinin, Ag+, Benzamidin og EDTA er inhibitorer af trypsin. | Peptidylaldehyder, boronsyrer og coumarinderivater er inhibitorer af chymotrypsin. |
Opsummering – Trypsin vs Chymotrypsin
Peptidaser eller proteolytiske enzymer sp alter proteiner via hydrolysen af peptidbindingen. Trypsin sp alter peptidbindingen ved basiske aminosyrer, mens chymotrypsin sp alter peptidbindingen ved aromatiske aminosyrerester. Begge enzymer er serinpeptidaser og virker i tyndtarmen i et basisk pH-miljø. På nuværende tidspunkt er meget forskning involveret i at producere trypsin og chymotrypsin ved hjælp af rekombinant DNA-teknologi ved at bruge forskellige bakterie- og svampearter, da disse enzymer har en høj industriel værdi. Dette er forskellen mellem trypsin og chymotrypsin.
Download PDF-versionen af Trypsin vs Chymotrypsin
Du kan downloade PDF-versionen af denne artikel og bruge den til offline-formål i henhold til citatnotat. Download venligst PDF-version her Forskel mellem trypsin og chymotrypsin