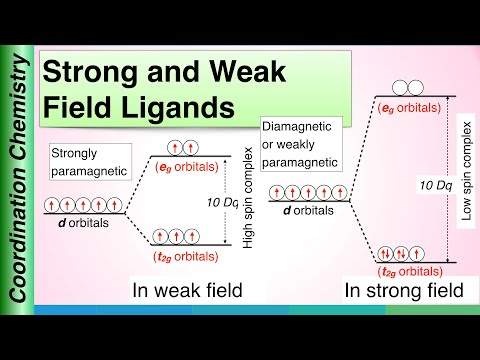
Nøgleforskel – stærk ligand vs svag ligand
En ligand er et atom, ion eller et molekyle, der donerer eller deler to af dets elektroner gennem en koordineret kovalent binding med et centr alt atom eller ion. Begrebet ligander diskuteres under koordinationskemi. Ligander er kemiske arter, der er involveret i dannelsen af komplekser med metalioner. Derfor er de også kendt som kompleksdannende midler. Ligander kan være monoodentate, bidentate, tridentate, etc. baseret på ligandens denticitet. Denticitet er antallet af donorgrupper til stede i en ligand. Monodentat betyder, at ligand kun har én donorgruppe. Bidentate betyder, at den har to donorgrupper pr. ligandmolekyle. Der er to hovedtyper af ligander kategoriseret baseret på krystalfeltteori; stærke ligander (eller stærke feltligander) og svage ligander (eller svage feltligander). Den vigtigste forskel mellem stærke ligander og svage ligander er, at opsplitning af orbitaler efter binding til en stærk feltligand forårsager en højere forskel mellem orbitaler med højere og lavere energiniveau, mens opsplitning af orbitaler efter binding til en svag feltligand forårsager en lavere forskel mellem orbitaler med højere og lavere energiniveau.
Hvad er krystalfeltteori?
Krystalfeltteori kan beskrives som en model, der er designet til at forklare nedbrydningen af degenerationer (elektronskaller med samme energi) af elektronorbitaler (norm alt d- eller f-orbitaler) på grund af det statiske elektriske felt, der produceres af en omgivende anion eller anioner (eller ligander). Denne teori bruges ofte til at demonstrere adfærden af overgangsmetalionkomplekser. Denne teori kan forklare de magnetiske egenskaber, farverne på koordinationskomplekser, hydreringsentalpier osv.
Teori:
Interaktionen mellem metalionen og ligander er et resultat af tiltrækningen mellem metalionen med en positiv ladning og den negative ladning af ligandens uparrede elektroner. Denne teori er hovedsageligt baseret på de ændringer, der sker i fem degenererede elektronorbitaler (et metalatom har fem d-orbitaler). Når en ligand kommer tæt på metalionen, er de uparrede elektroner tættere på nogle d orbitaler end andre d orbitaler af metalionen. Dette forårsager tab af degeneration. Og også elektronerne i d-orbitalerne frastøder ligandens elektroner (fordi begge er negativt ladede). Derfor har d-orbitaler, der er tættere på liganden, høj energi end andre d-orbitaler. Dette resulterer i opsplitning af d orbitaler i højenergi d orbitaler og lavenergi d orbitaler baseret på energien.
Nogle faktorer, der påvirker denne opdeling er; metalionens natur, metalionens oxidationstilstand, arrangementet af ligander omkring den centrale metalion og ligandernes natur. Efter opsplitning af disse d-orbitaler baseret på energi, er forskellen mellem høj- og lavenergi-d-orbitaler kendt som en krystalfeltopdelingsparameter (∆oct for oktaedriske komplekser).
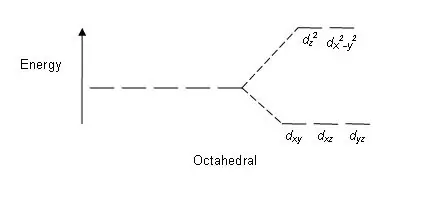
Figur 01: Opdelingsmønster i oktaedriske komplekser
Sp altningsmønster: Da der er fem d-orbitaler, sker sp altningen i forholdet 2:3. I oktaedriske komplekser er to orbitaler i det høje energiniveau (samlet kendt som 'eg'), og tre orbitaler er i det lavere energiniveau (samlet kendt som t2g). I tetraedriske komplekser sker det modsatte; tre orbitaler er i det højere energiniveau og to i det lavere energiniveau.
Hvad er Strong Ligand?
En stærk ligand eller en stærk feltligand er en ligand, der kan resultere i en højere krystalfeltopdeling. Dette betyder, at bindingen af en stærk feltligand forårsager en større forskel mellem orbitaler med højere og lavere energiniveau. Eksempler omfatter CN– (cyanidligander), NO2– (nitroligand) og CO (carbonyl) ligander).
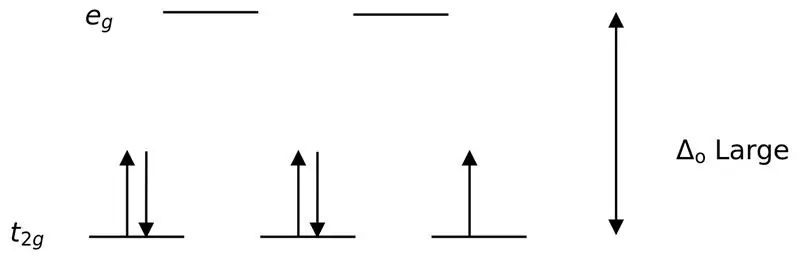
Figur 02: Lav spin-opdeling
Ved dannelsen af komplekser med disse ligander bliver de lavere energiorbitaler (t2g) i starten fuldstændig fyldt med elektroner før de fyldes til andre orbitaler med højt energiniveau (f.eks.). De komplekser, der dannes på denne måde, kaldes "lav spin komplekser".
Hvad er svag ligand?
En svag ligand eller en svag feltligand er en ligand, der kan resultere i en lavere krystalfeltsp altning. Dette betyder, at bindingen af en svag feltligand forårsager en mindre forskel mellem orbitaler med højere og lavere energiniveau.
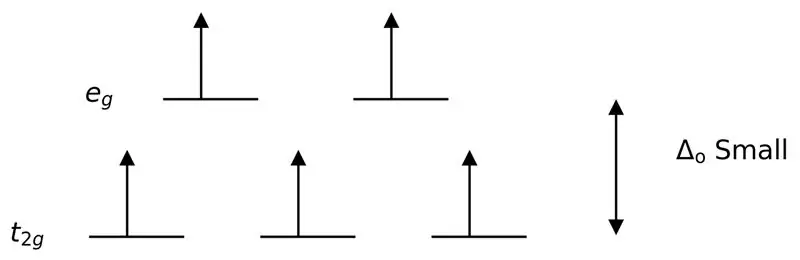
Figur 3: High Spin Splitting
I dette tilfælde, da den lave forskel mellem de to orbitalniveauer forårsager frastødninger mellem elektroner i disse energiniveauer, kan orbitaler med højere energi let fyldes med elektroner sammenlignet med orbitaler med lav energi. De komplekser, der dannes med disse ligander, kaldes "høj spin komplekser". Eksempler på svage feltligander omfatter I– (iodidligand), Br– (bromidligand), osv.
Hvad er forskellen mellem stærk ligand og svag ligand?
Stærk Ligand vs Weak Ligand |
|
| En stærk ligand eller en stærk feltligand er en ligand, der kan resultere i en højere krystalfeltsp altning. | En svag ligand eller en svag feltligand er en ligand, der kan resultere i en lavere krystalfeltsp altning. |
| Teori | |
| Sp altningen efter binding af en stærk feltligand forårsager en større forskel mellem orbitaler med højere og lavere energiniveau. | Sp altningen af orbitaler efter binding af en svag feltligand forårsager en mindre forskel mellem orbitaler med højere og lavere energiniveau. |
| Kategori | |
| Komplekserne dannet med stærke feltligander kaldes "lav spin komplekser". | Komplekserne dannet med svage feltligander kaldes "højspinkomplekser". |
Opsummering – stærk ligand vs svag ligand
Stærke ligander og svage ligander er anioner eller molekyler, der forårsager opsplitning af d orbitaler af en metalion i to energiniveauer. Forskellen mellem stærke ligander og svage ligander er, at opsplitning efter binding af en stærk feltligand forårsager en højere forskel mellem orbitaler med højere og lavere energiniveau, hvorimod opsplitning af orbitaler efter binding af en svag feltligand forårsager en mindre forskel mellem højere og lavere energiniveau. energiniveau orbitaler.