Nøgleforskel – koordinationsforbindelse vs organometallisk forbindelse
Koordinationsforbindelser og organometalliske forbindelser er komplekse forbindelser. Den vigtigste forskel mellem koordinationsforbindelse og den organometalliske forbindelse er, at koordinationsforbindelser indeholder koordinerede kovalente bindinger, mens organometalliske forbindelser indeholder metal-carbon-bindinger.
Koordinationsforbindelser er komplekse forbindelser sammensat af en metalion omgivet af molekyler eller ioner rige på elektroner. Disse omgivende komponenter er kendt som ligander. Organometalliske forbindelser er komplekse forbindelser, hvori der eksisterer metal-carbon kovalente bindinger. Hvis der er mindst én metal-carbon-binding, betragtes denne forbindelse som en organometallisk forbindelse.
Hvad er Coordination Compound?
Koordinationsforbindelser er komplekse forbindelser, der indeholder centrale metalatomer eller ioner omgivet af elektronrige molekyler eller ioner kendt som ligander. Disse ligander er bundet til metalatomet (eller ionen) via koordinerede kovalente bindinger. En koordinat kovalent binding dannes, når enlige elektronpar af en ligand doneres til tomme d-orbitaler af et metalatom eller en metalion. Det meste af tiden gennemgår overgangsmetalatomer denne type forbindelsesdannelse, fordi disse atomer er rige på tomme d-atomare orbitaler.

Figur 01: Et metal-EDTA-kompleks er en koordinationsforbindelse
Koordinationsforbindelser kan være neutrale (Co(NH3)Cl3), positivt ladede ([Nd(H) 2O)9]3) eller negativt opladet ([UF8]4). De ladede koordinationsforbindelser er også kendt som komplekse ioner. Forskellige koordinationskomplekser har forskellige strukturer kendt som geometrier. Geometrien af en koordinationsforbindelse bestemmes af kompleksets koordinationsnummer. Koordinationsnummer er antallet af ligander bundet til det centrale metalatom eller ion.
- Koordinationsnummer=2 er den lineære geometri
- Koordinationsnummer=3 er den trigonale plane geometri
- Koordinationsnummer=4 er den tetraedriske eller kvadratiske plane geometri
- Koordinationsnummer=5 er den trigonale bipyramidale geometri
- Koordinationsnummer=6 er den oktaedriske geometri
- Koordinationsnummer=7 er den femkantede bipyramidale geometri
- Koordinationsnummer=8 er den firkantede antiprismatiske geometri
Hvad er organometallisk forbindelse?
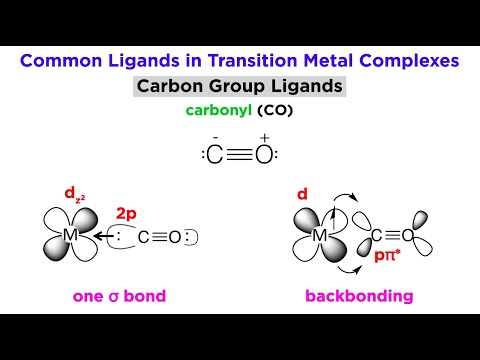
Organometalliske forbindelser er komplekse forbindelser, hvori der findes metal-kulstof-kovalente bindinger. Disse forbindelser har kovalente bindinger mellem carbon- og metalatomerne. Der er dog også nogle undtagelser; metal-cyano-bindinger betragtes ikke som organometalliske bindinger. Metalcarbonylkomplekser betragtes som organometalliske forbindelser.
Metalet involveret i dannelsen af organometallisk kemisk binding kan være et alkalimetal, jordalkalimetal, et overgangsmetal eller kan endda være et metalloid såsom bor. Nogle almindelige eksempler på organometalliske forbindelser er Grignard-reagens, der indeholder enten Lithium (Li) eller Magnesium (Mg), ferrocen, tetracarbonylnikkel osv. Bor er et metalloid, men det danner også organometalliske forbindelser såsom organoboranforbindelser.

Figur 02: Ferrocæn
Organometalforbindelser er gode kilder til nukleofile carbonatomer. Det skyldes, at metallets elektronegativitet er meget lav sammenlignet med kulstof. Derfor kan metalatomet nemt danne en kation ved at give bindingselektroner til carbonatomet. Nu er carbonatomet rig på elektroner, og kan derfor fungere som en nukleofil. Denne kulstofnukleofil kan angribe elektrofile kulstofatomer og danne nye kulstof-kulstofbindinger.
Hvad er forholdet mellem koordinationsforbindelse og organometallisk forbindelse?
Nogle koordinationsforbindelser indeholder metalioner omgivet af organiske ligander. Hvis disse ligander er bundet til metalatomet via heteroatomer såsom oxygen og nitrogen, så betragtes forbindelsen som en koordinationsforbindelse. Men hvis der er direkte bindinger mellem carbonatomer og metalatomet, så betragtes det som en organometallisk forbindelse
Hvad er forskellen mellem koordinationsforbindelse og organometallisk forbindelse?
Coordination Compound vs Organometallic Compound |
|
| Koordinationsforbindelser er komplekse forbindelser, der indeholder centrale metalatomer eller ioner omgivet af elektronrige molekyler eller ioner kendt som ligander. | Organometalforbindelser er komplekse forbindelser, hvori der findes metal-kulstof-kovalente bindinger. |
| Kemisk binding | |
| Koordinationsforbindelser indeholder koordinerede kovalente bindinger mellem metalatomer og ligander. | Organometalforbindelser indeholder mindst én metal-carbon-kovalent binding. |
| Components | |
| Koordinationsforbindelser indeholder metalatomer eller ioner og elektronrige ligander. | Organometalforbindelser indeholder metalatomer og en organisk del af et molekyle. |
| Farve | |
| Næsten alle koordinationsforbindelserne er meget farverige baseret på oxidationstilstanden af det centrale metalatom. | Organometalforbindelser er ikke dybest set farverige. |
Opsummering – Koordinationsforbindelse vs organometallisk forbindelse
Koordinationsforbindelser er komplekse forbindelser sammensat af et metalatom eller en metalion omgivet af elektronrige ligander. Disse ligander er bundet til metalatomet via koordinerede kovalente bindinger. Organometalliske forbindelser er komplekse forbindelser, der har mindst en metal-kulstofbinding. Forskellen mellem koordinationsforbindelse og den organometalliske forbindelse er, at koordinationsforbindelser indeholder koordinerede kovalente bindinger, mens organometalliske forbindelser indeholder metal-carbon-bindinger.