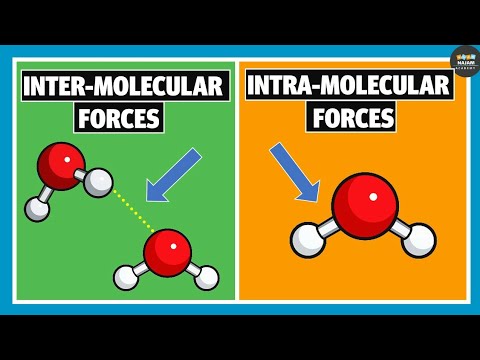
Nøgleforskel – intermolekylær vs intramolekylær hydrogenbinding
Hydrogenbinding er en form for tiltrækningskraft mellem visse polære molekyler. det er en form for svag binding end ioniske eller kovalente bindinger, men er stærke tiltrækningskræfter sammenlignet med dipol-dipolkræfter og Van der Waal-kræfter. En hydrogenbinding dannes, hvis det polære molekyle har et stærkt elektronegativt atom med et ensomt elektronpar (som kan fungere som en elektrondonor) bundet til et hydrogenatom (en elektronacceptor). da det stærkt elektronegative atom kan tiltrække bindingselektronen par mod sig selv end et brintatoms, får brintatomet en delvis positiv ladning, hvilket resulterer i en stærk ladningsadskillelse. Derfor er de almindelige hydrogenbindinger, der danner kemiske bindinger, O-H-binding, N-H-binding og F-H-binding. Der er to former for hydrogenbindinger, der kan dannes; intermolekylær hydrogenbinding, der opstår mellem polære molekyler og intramolekylær hydrogenbinding, der forekommer i det samme enkelt molekyle. Den vigtigste forskel mellem intermolekylær og intramolekylær hydrogenbinding er, at intermolekylær hydrogenbinding forekommer mellem to molekyler, hvorimod intramolekylær hydrogenbinding forekommer i et enkelt molekyle.
Hvad er intermolekylær hydrogenbinding?
Intermolekylære hydrogenbindinger opstår mellem separate molekyler i et stof. Derfor bør elektrondonoren og elektronacceptoren være til stede i to separate molekyler. Hvis korrekte elektrondonorer og -acceptorer er til stede, kan ethvert molekyle danne hydrogenbindinger.

Figur 01: Intermolekylær hydrogenbinding i vandmolekyler
Et almindeligt eksempel på molekyler, der kan danne intermolekylære hydrogenbindinger, er vandmolekyler (H2O). Hydrogenbindingerne mellem vandmolekylerne forårsager dannelsen af en stiv struktur når flydende vand omdannes til fast is.
Hvad er intramolekylær hydrogenbinding?
Intramolekylære hydrogenbindinger er dem, der forekommer inden for et enkelt molekyle. Denne type hydrogenbinding opstår, når to funktionelle grupper, der er i stand til at danne hydrogenbindinger med hinanden, er til stede i det samme enkelt molekyle. Det betyder, at både elektrondonor og elektronacceptor skal være til stede i det samme molekyle.

Figur 02: Intramolekylær hydrogenbinding i salicylaldehyd
Desuden bør disse to funktionelle grupper placeres tæt nok på for denne hydrogenbinding. Det mest almindelige eksempel på et molekyle, der viser denne type hydrogenbinding, er salicylaldehyd(C7H6O2).
Hvad er forskellen mellem intermolekylær og intramolekylær hydrogenbinding?
Intermolekylær vs intramolekylær hydrogenbinding |
|
| Intermolekylære hydrogenbindinger opstår mellem separate molekyler i et stof. | Intramolekylære hydrogenbindinger er dem, der forekommer inden for et enkelt molekyle. |
| Komponenter | |
| Intermolekylære hydrogenbindinger dannes mellem to molekyler. | Intramolekylære hydrogenbindinger dannes mellem separate molekyler. |
Opsummering – Intermolekylær vs intramolekylær hydrogenbinding
Hydrogenbinding er en form for dipol-dipol-interaktion. Men det er en svag bindingstype. Der er to former for hydrogenbinding som intermolekylære og intramolekylære hydrogenbindinger. Forskellen mellem intermolekylær og intramolekylær hydrogenbinding er, at intermolekylær hydrogenbinding forekommer mellem to molekyler, hvorimod intramolekylær hydrogenbinding forekommer i et enkelt molekyle.