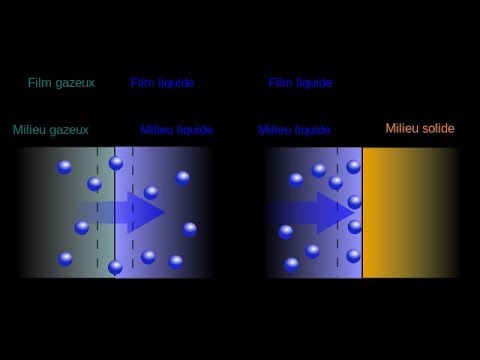
Nøgleforskellen mellem absorption og adsorption er, at ved absorption tager ét stof (stof eller energi) et andet stof ind i det pågældende stof, hvorimod det kun er overfladeniveau-interaktioner, der finder sted ved adsorption.
Sorption er den proces, hvor et stof optager eller holder på et andet stof. Dette kan være et kemisk fænomen, da kemiske bindinger er involveret i at optage og holde på to stoffer. Sorption er fordelagtig i nogle tilfælde, men nogle gange er det også ufordelagtigt. For eksempel kan sorption reducere jordnær vandforurening. Når vi tilføjer forurenende stoffer til jorden, tiltrækkes de af jorden; dermed bremses deres bevægelse til underjordiske jordlag. Til sidst vil dette resultere i lav forurening. Da sorptionsreaktioner opstår hurtigt, tager det kortere tid. Sorption kan være af to typer, absorption og adsorption.

Hvad er absorption?
Ved absorption optages et stof i det andet stofs fysiske struktur. Stoffet, som absorberes i et andet stof, er "absorbatet". Stoffet, der absorberer absorbatet, er det "absorberende".
For eksempel, hvis et organisk molekyle går ind i en fast partikel (jordpartikel), så er det organiske molekyle absorbatet, og jordpartiklen er absorbenten. Absorbenten kan være en gas, væske eller et fast stof, hvorimod absorbatet kan være et atom, ion eller et molekyle. Norm alt er absorbat og absorbenten i to forskellige faser.

Figur 01: Absorption vs Absorption
Kemikaliers absorptionsegenskaber bruges ved forskellige lejligheder. Dette er for eksempel princippet bag væske-væske-ekstraktion. Her kan vi udtrække et opløst stof fra en væske til en anden væske, fordi det opløste stof er mere absorberet i den ene væske end den anden, når de er i samme beholder. For at absorbere bør absorbenten have en porøs struktur eller tilstrækkelig plads, som absorbatet kan rumme. Desuden bør det absorberende molekyle have en passende størrelse til at gå ind i den absorberende struktur. Yderligere letter tiltrækningskræfterne mellem to komponenter absorptionsprocessen. Samme som en masse; energi kan også undergå absorption (til stoffer). Dette er grundlaget bag spektrofotometri. Der absorberer atomer, molekyler eller en anden art lys.
Hvad er adsorption?
Ved adsorption tiltrækkes et stof eller energi til en overflade af et andet stof. Det tiltrukne stof er "adsorbat", og overfladen er "adsorberende". Tiltrækningen mellem organiske materialer og aktivt kul er et eksempel på adsorption. Organisk materiale er adsorbatet i denne lejlighed, og adsorbenten er aktivt kul.
Et andet eksempel på adsorption er at tiltrække protein til biomateriale. Adsorption forekommer i tre typer, fysisk adsorption, kemisorption og elektrostatisk adsorption. Ved fysisk adsorption er svage van der Waals-kræfter tiltrækningskræfterne. Ved kemisorption sker tiltrækningen via en kemisk reaktion mellem adsorbenten og adsorbatet. Som navnet antyder, dannes der ved elektrostatisk adsorption elektrostatiske interaktioner mellem ioner og overfladerne.
Hvad er forskellen mellem absorption og adsorption?
Absorption vs Adsorption |
|
| Ved absorption optages et stof i det andet stofs fysiske struktur. | Ved adsorption tiltrækkes et stof eller energi til en overflade af et andet stof. |
| Kemiske arter | |
| De to stoffer, der er involveret i absorptionen, er absorbatet og det absorberende. | De to stoffer, der er involveret i adsorption, er adsorbatet og adsorbenten. |
Oversigt – Absorption vs Adsorption
Absorption og adsorption er to former for sorptionsprocesser. Forskellen mellem absorption og adsorption er, at ved absorption tager et stof (stof eller energi) et andet stof ind i det pågældende stof, hvorimod der ved adsorption kun finder overfladeniveau-interaktioner sted.